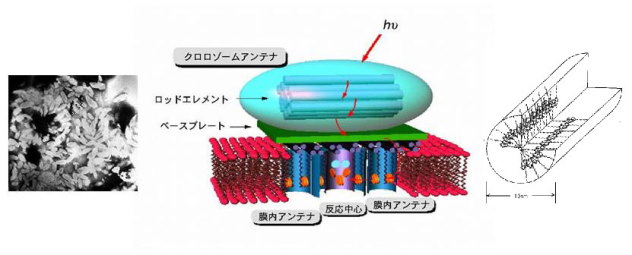
光受容アンテナの構造と機能
植物や光合成バクテリアは、太陽のエネルギーを化学エネルギーに変える光合成を行っているが、そこでは、希薄な密度の光子を効率的に集めるため、多数の光合成色素からなるアンテナのような精巧な分子集合体が用いられている。すなわち、クロロフィル色素と、それらを空間特異的に保持した蛋白質からなる分子集合体である。その特異なナノメートルスケールの空間形態により、吸収された光エネルギーは色素間を高速で移動し、ほぼ100%の量子収率で反応中心に到達し、光電子変換反応を誘起する。光捕集複合体には主として細胞膜のすぐ内側に位置する色素分子と脂質からなるクロロゾームアンテナ(chlorosome antenna)及び色素分子と蛋白質が錯体を作った膜内アンテナ(membrane antenna, LH1 and LH2)が存在する。アンテナの機能解明にはそれを構成する色素、脂質とタンパク質の構造を原子レベルで解析することが不可欠であるが、高等植物についてはその単離精製の難しさと複雑な構造の故に未だに未解明のところが多い。そこで、当研究室では、より容易に研究が行える光合成細菌を対象に、そのアンテナ構造と機能の解明研究を進めてきた。
1.クロロゾームアンテナ
緑色細菌のクロロゾームアンテナの存在は1980年代から電子顕微鏡の観察により認められ、形態としては長さ約130nm〜250nm、幅約40nm〜80nmの米粒の形をしていることがわかっている(下、左の写真)。クロロゾームは主に糖脂質よりなる一層の膜で囲まれた米粒の形をしているアンテナ器官(クロロフィル、全重量の約50%以上)である。反応中心当たりの光捕集クロロフィルの分子数は1000〜1500分子と言われる。クロロゾーム1個あたり、クロロフィル分子が光捕集色素として約104分子存在しているので、1個のクロロゾームは数10分子の反応中心にエネルギーを伝達することになる(中央の模式図)。一方、フリーズフラクチャー法による観察ではクロロゾームの内部に直径約10nm程度の"ロッドエレメント(rod element、右のモデル)"と呼ばれる棒状構造が見られ、ここには色素分子が会合体の形として存在していると考えられる。これまで色素分子はタンパク質に結合せずそれ自身の集合によって特定の高次構造をとっている色素−色素説も強く打ち出されている。その証拠として、クロロゾームから単離した色素分子が非極性溶媒の中でクロロゾームと類似の分光学的挙動を示す会合体を形成できること、タンパク質を選択的に取り除いたクロロゾームは元のものと同じ分光学的挙動を示すことなどが挙げられる。

光生物のアンテナ器官中の色素分子は、通常一定規模の会合体を形成して、光エネルギー伝達の役割を果たす。最近、緑色光合成細菌のクロロゾームアンテナについて、当研究室ではそれを構成するバクテリオクロロフィル(BChl) cが非常に安定な二量体を形成することを中性子散乱で突き止め、その会合構造を高分解能核磁気共鳴法(NMR)によって決定した。非極性有機溶媒中において、BChl cが非対称なダイマーを形成し、その構造は極めて安定であるため、よく分離されたシグナルを観測することができた。磁化移動、2次元同種・異種核相関の測定より、完全なBChl cダイマーにおける1H-、13C-と15N-NMRの全ケミカルシフトの同定を行った。その結果、会合体の形成に伴い、クロリン環同士に生じた立体障害に対処するため、メソ位以外の自由度の高い置換基は多彩な挙動を示すことを判明した。ファルネシル長鎖エステル基も、会合体コアの部分と離れることなく、クロリン環と絡み合っていることがわかった。さらに、特定の官能基における分子間NOE効果の測定から、ダイマー中におけるそれぞれの分子の精密な配置関係を決定することができた。このダイマー構造の形成は近赤外領域におけるBChl c 本来の吸収極大波長が約40nmレッドシフトすることをもたらしている。
クロロゾーム中の色素分子の配向状態について様々なモデルが提案されている。従来の会合モデルでは長いエステル鎖の役割はあまり考慮されていなかった。これは従来の研究焦点が色素−タンパク質間の相互作用、あるいは色素間の局所的な、特にクロリン環同士の、相互作用に絞られてきたためである。そこで、野澤らはリングオーバーラップモデルをもとにこれまで注目されていなかった長いエステル鎖などの側鎖構造も考慮し、クロロゾーム内部のBChl cの会合構造についてミセル類似のモデルを提案した。ロッドエレメントの直径が約10nmであること、Qy 遷移がクロロゾームの長軸に平行に並んでいることなどの実験事実と矛盾しないことから、このような棒状構造が最も妥当であると考えられる。
2.膜内アンテナ
膜内アンテナには、反応中心を直接取り囲んでいるI型のLH1アンテナと更にそれと相互作用するようにLH1を取り囲んでいるII型と呼ばれるLH2アンテナが知られている。色素と膜蛋白質との相互作用の結果、色素が単独で存在する場合と異なる様々な波長に吸収極大をもっている。生物はこれらの組合せにより幅広い波長の光の利用を可能にし、吸収した光エネルギーを巧みに効率よく集光する光捕獲系を構築している。LH2アンテナ複合体については、原子レベルでの結晶構造が既に解明されて、それに基づく機能解明の研究が現在進んでいる。一方、LH1複合体については、原子レベルでの構造解析はまだ完成されていない。現在最も高い分解能(8.5Å)で観測されたのはRhodospirillum rubrum (R. rubrum) 由来のLH1再構成複合体である。LH1複合体はaとbポリペプチド鎖をもち、それぞれ約50前後のアミノ酸残基から構成される。両ポリペプチド鎖とも膜貫通ヘリックス構造をとり、その中でヒスチジン残基のイミダゾールは色素(BChl a)分子のMgと配位結合をつくっていると考えられる。BChl a以外に、さらにサブユニット当たり1個のカロチノイドが含まれる。電子密度の投影マップから16個のサブユニットがリング状の構造を形成し、各サブユニットからは三つの異なるドメインが認められた。リングの平均外径と内径はそれぞれ116Åと68Åである。これは十分反応中心複合体を真ん中に収容できる大きさである。三つのドメインはおそらくaとbポリペプチド鎖及び色素分子に対応するであろう。
LH1複合体は多数の同一サブユニットからなるリング状構造を形成し、1つのサブユニットは2分子のBChl a と一組のa,bポリペプチドにより構成される。LH1は界面活性剤の濃度調整により近赤外の吸収極大波長が不連続的に変化する。中性子小角散乱によりB820と呼ばれる色素・蛋白質複合体は一個のサブユニットに当たる構造体であるを明らかにした。蛋白質内での色素分子の配置を調べるために、13Cで標識されたBChl a 分子を高濃度でアポ蛋白内に組み込む独自の再構成法を確立し、生理活性のある条件下でNMR測定を試みた。その結果、B820における色素由来のすべてのシグナルが同定され、多くの官能基について化学シフトと緩和時間が有機溶媒中のものと大きく異なることを見出した。これらの情報はアンテナ中における色素同士、色素・蛋白質間の相互作用を調べる上で、重要な手がかりを与えるものと考えられる。
詳しくは、J. Am. Chem. Soc. 124, 1072-1078(2002)をご参照ください